La médecine conventuelle est née en Italie dans l’abbaye de Montecassino, fondée en 529 après J.-C. par Benedetto da Norcia, et s’est répandue de monastère en monastère dans la plupart des pays d’Europe continentale, transmettant son héritage culturel par le biais des Hortuli, des livres manuscrits contenant la description des “simplex” (simples) cultivés dans les jardins des monastères et avec lesquels les médicaments étaient préparés. Entre les treizième et quatorzième siècles s’est établie la “galénique”, appelée plus tard “technique pharmaceutique”, qui avait pour tâche de mettre au point la manière de préparer les différentes préparations médicinales à administrer sous la forme la plus appropriée. En 1231, dans le royaume de Sicile, comme cela s’était déjà produit dans le monde islamique, la profession de pharmacien est séparée de celle de médecin : en septembre de cette année-là, en effet, Frédéric II de Souabe, avec l’aide d’éminents juristes comme Pier della Vigna et Taddeo di Sessa, publie le Liber Augustalis, connu sous le nom de Constitutions de Melfi, qui distingue avec une extrême précision la pratique du médecin de celle du pharmacien, appelé “aromatario”, c’est-à-dire vendeur d’arômes (qui deviendra plus tard apothicaire). 51,52 Cette séparation a été rendue nécessaire par la disponibilité accrue de médicaments à base de plantes – garantie depuis le 11e siècle par la réouverture du commerce avec l’Asie et l’Afrique par les républiques dites maritimes – que les médecins ne savaient souvent pas manipuler et qui nécessitaient les services d’un spécialiste.
Histoire du médicament
La recherche de remèdes efficaces contre la douleur et la maladie caractérise l’histoire de l’humanité depuis ses débuts. Les premières formes de pharmacologie remontent probablement aux tentatives des hommes dits primitifs de reconnaître les propriétés bénéfiques contenues dans les herbes, les eaux de source et les substances alimentaires. À ces tentatives, qui se perfectionnèrent progressivement, s’ajouta bientôt une série de théories unies par l’idée que l’action thérapeutique pouvait être renforcée par le recours à des pratiques magico-religieuses capables de faciliter la guérison en “expulsant” du corps du malade le “mauvais esprit” responsable de la maladie. La médecine magique sacerdotale a d’ailleurs longtemps joué un rôle prédominant dans la dynamique culturelle de nombreux groupes ethniques, traversant en fait toutes les civilisations anciennes, de l’Assyro-Babylonienne à la Phénicienne, de la Crétoise à la Mycénienne, de la Chinoise à l’Indienne, de l’Égyptienne à la Grèce préclassique. Ce sera avec Hippocrate, dans l’Athènes du Ve siècle avant J.-C., que la pratique médico-pharmaceutique s’émancipera de cette sorte de théurgie scientifique, pour tendre vers un type de connaissance fondé sur l’observation et l’expérience. Avec la célèbre “doctrine des quatre humeurs” (flegme, sang, bile noire et bile jaune), le médecin de Coo élabore une théorie qui est destinée à dominer la médecine dogmatique jusqu’à Galien qui, à son tour, la remanie, la consacrant comme une référence irréfutable jusqu’à la Renaissance. À partir des suggestions proposées par Alcméon, et avant lui par Anaximène (théorie des quatre éléments fondamentaux, l’air, l’eau, le feu et la terre) et Empédocle (théorie de l’origine “racinaire” de toute chose), Hippocrate soutient que les humeurs, ou liquides organiques, sont multiples et agissent dans le corps par le biais de dynameis (caractéristiques) indéfinies, une position reprise plus tard par Anaxagore avec l’idée de l’infinité des “graines”.
En d’autres termes, les humeurs ne constituent pas quelque chose d'”immobile”, puisque, précisément parce qu’elles sont des liquides organiques, elles peuvent se transmuter entre elles et faire interagir les différentes dynamées présentes (par exemple, l’acidité, l’astringence ou la “douceur”), générant ainsi d’innombrables combinaisons possibles et, par conséquent, des situations. De même, avec une foule d’autres facteurs (anatomiques, alimentaires, géographiques), les humeurs influencent la configuration des types psychosomatiques qui servent “de règles directrices dans l’évaluation de la multiplicité des cas individuels”. Ainsi, seule l’observation empirique peut révéler l’importance de certaines humeurs par rapport à d’autres dans les processus morbides, ce qui explique que ” le flegme était appelé le liquide blanchâtre, froid et âcre qui apparaissait dans les maladies du système respiratoire ou dans les maladies aiguës des yeux ” ; la notion de bile noire pourrait également provenir des matières fécales des malades souffrant d’ulcères gastriques, de certains vomissements, de l’urine produite par une forme de malaria ; la bile jaune également des vomissements et autres sortes de matières fécales”.
La médecine grecque et, en général, la médecine antique, ne connaissaient cependant pas l’activité pathogène des micro-organismes et, de fait, attribuaient l’origine des maladies épidémiques à l’air chargé de miasmes (pensons, par exemple, à l’expression “mauvais air” dont dérive le nom de la malaria) et aux variations du temps et du climat.
Les médecines grecques se concentraient donc sur les états d’intoxication, réels ou supposés, qui étaient censés compromettre l’équilibre de l’organisme et, par conséquent, la santé. La recherche continue de remèdes dans cette direction leur a permis d’accumuler une riche expérience, jetant les bases de la toxicologie moderne. À cet égard, il est possible d’indiquer, comme l’un des premiers rapports toxicologiques, le compte rendu précis donné par Platon dans le Phédon, sur les propriétés du jus de ciguë à l’occasion de la mort de Socrate : “la description donnée par le philosophe grec de la paralysie des nerfs sensitifs et moteurs, avec dépression du système nerveux central (SNC) et apparition d’une paralysie respiratoire, coïncide très bien avec les actions, connues aujourd’hui, de l’alcaloïde de la ciguë, la Coniine”.
L’observation directe de la nature, la classification de ses phénomènes, l’élaboration d’une casuistique ou la compilation finale de corpus, sont quelques-uns des traits distinctifs de l’approche épistémologique des Étrusques et témoignent de la manière dont ce peuple avait compris les éléments constitutifs d’une science proprement dite, bien que mûrie et gérée avec des stimuli et des intentions religieuses magiques.
Ancienne civilisation et médecine
La civilisation étrusque, qui s’est établie à partir du IXe siècle avant J.-C. dans une région comprenant les actuelles régions italiennes de la Toscane, de l’Ombrie et du nord du Latium, mais aussi de vastes zones de la Ligurie, de l’Émilie-Romagne, de la Lombardie et de la Campanie, a influencé la culture romaine pendant plus d’un demi-millénaire. Et pourtant, les Romains ne se sont pas contentés de les vaincre militairement mais – il faut bien le dire – ils ont phagocyté leurs us et coutumes, effaçant les stigmates de leur existence, dont il reste d’ailleurs des échos dans les références occasionnelles des œuvres d’auteurs grecs et latins et dans les nombreux et impressionnants sites archéologiques. Il ne faut donc pas s’étonner si, dans le monde antique, les Étrusques jouissaient d’une renommée exceptionnelle pour leurs connaissances en médecine (et, en particulier, en techniques dentaires dont ils étaient, à l’époque, les maîtres incontestés), en chirurgie et en phytothérapie.
Leur Weltanschauung reposait sur l’idée que chaque aspect et élément de la nature avait un sens, une valeur, une efficacité, parce qu’il était l’expression d’une énergie capable d’agir sur l’homme aussi bien de manière bénéfique que maléfique. C’est précisément sur la base de cet axiome que les Étrusques ont défini un système médical qui, régi par un petit cercle de membres de l’ordre sacerdotal, reposait sur une vaste pharmacopée et sur l’utilisation des eaux thermales à des fins curatives.
L’importance de cette pharmacopée était déjà soulignée par Dioscoride, qui mentionne treize essences de plantes auxquelles les Étrusques reconnaissaient des vertus médicinales, encore acceptées aujourd’hui18. De plus, la possibilité de disposer, avec une certaine facilité, d’une abondante végétation méditerranéenne basse et buissonnante de plantes riches en sucs tonifiants et stimulants, comme, par exemple, la Sauge, le Romarin, le Thym et la Marjolaine, ou de plantes arbustives et herbacées à haute teneur en huiles essentielles, a facilité la conception de produits phytopharmaceutiques efficaces.
En outre, les Étrusques ont également inclus dans leur pharmacologie certains minéraux tels que la limaille de fer et l’oxyde de fer (pour combattre l’anémie), le cuivre (pour calmer les inflammations) et certains sels (sodium et potassium). On ne sait pas, cependant, s’ils utilisaient leurs médicaments “simples” ou en combinaison les uns avec les autres, tandis qu’il est probable que les plantes médicinales étaient utilisées sous forme d’empâtements, d’onguents et de pommades, préparés en utilisant des graisses de différentes sortes et de l’huile d’olive comme excipients.
Pharmacologie ancienne
Les connaissances grecques et étrusques en matière de pharmacologie ont été acquises et perfectionnées à Rome, où le nombre de produits végétaux utilisés en thérapie a considérablement augmenté. D’autre part, les Romains ont longtemps vécu dans une condition d’infériorité scientifique par rapport à ces civilisations qui, comme nous l’avons vu, ont développé leurs connaissances sur la base d’expériences concrètes et de résultats vérifiés. A Rome, au contraire, une série de médecines et de pharmacologies primitives ont dominé pendant plusieurs siècles, comme les médecines théurgiques, sacerdotales, magiques et patriarcales, expressions de superstitions ou, tout au plus, d’expériences empiriques quotidiennes. Le passage de ces conceptions primitives, qui n’ont cependant jamais complètement disparu, à une médecine-pharmacologie fondée sur des critères plus rationnels, a été lent et progressif. Une étape importante de ce parcours a sans doute été le décret de 46 av. J.-C. de Jules César, qui accordait la citoyenneté romaine “précieuse” et “désirée” aux médecins et enseignants n’appartenant pas à la république. Suite à ce décret, le nombre de médecins a augmenté de façon exponentielle et la majorité d’entre eux, issus des écoles grecques ou égyptiennes, ont diffusé à Rome la médecine scientifique de leur temps.
La médecine dans la Rome impériale est donc devenue la synthèse de différentes traditions et comprenait, outre les cures thermales, des médicaments dérivés des règnes minéral, animal et végétal, administrés sous forme d’infusions, de macérations, de décoctions, de jus, de poudres, de pilules, de comprimés, d’onguents, de cataplasmes, de cataplasmes, de gouttes pour les yeux et d’écouvillons.
Une liste détaillée des préparations utilisées par les Romains a été dressée à l’époque néronienne par Dioscoride de Pedanio d’Anazarba. On attribue à Dioscoride le mérite d’avoir été le premier à rassembler tous les principes qui existaient à l’époque sur les drogues, en les ordonnant de manière systématique dans le traité On materia medica, une œuvre destinée à rester pendant quinze siècles la plus autorisée en son genre.
Parmi les illustres cliniciens, cependant, se détache la figure de Galien, médecin de cour de l’empereur Marc Aurèle, qui a fait revivre avec une approche nouvelle et originale la combinaison de la médecine d’inspiration hippocratique et de la philosophie.32 L’idée de base était que le médecin devait, d’une part, “posséder une grande richesse de connaissances dans les domaines anatomique, physiologique, chirurgical, pharmacologique et diététique” et, d’autre part, “acquérir une maîtrise considérable des principaux domaines de la recherche philosophique, y compris notamment la gnoséologie, la psychologie et l’éthique”.
De cette manière, il serait possible de traiter simultanément la condition physique et l’état mental et moral d’un patient. Selon Galien, en effet, le corps, l’esprit et l’âme constituaient un tout qui ne pouvait être séparé au cours de la thérapie et devait tendre vers une dimension d’équilibre constant. Ce n’est pas un hasard si, outre le régime alimentaire et l’exercice physique, les évacués ont joué un rôle de premier plan dans la thérapie galénique, administrée selon le principe contraria contrariis curantur, c’est-à-dire en provoquant des symptômes antagonistes aux manifestations de la maladie. La condition parfaite d’équilibre pourrait donc être atteinte par l’individu grâce au développement d’une véritable “éthique de la tempérance” visant non seulement à guérir, mais aussi à prévenir les comportements nuisibles, en moralisant les désirs tant dans la sphère de l’alimentation que dans les habitudes de vie.
L’énorme succès des idées de Galien – devenant pendant longtemps la pierre angulaire incontestée et incontestable de la médecine occidentale – constituera, comme un incroyable paradoxe, un frein non indifférent au progrès de la science médicale, jusqu’au moment où, à partir du XVIIe siècle, les technologies et les nouvelles connaissances remettront en cause ses pierres angulaires.
La culture arabe qui, avec la désintégration de l’Empire romain, s’est superposée et a remplacé la culture gréco-latine dans de vastes zones du bassin méditerranéen, a valorisé dans le domaine pharmacologique l’utilisation des plantes médicinales et a interprété les grands classiques de l’époque – principalement Galien, mais aussi Hippocrate et Dioscoride – en les sortant de l’oubli causé par les “invasions-migrations barbares”.
De plus, la conquête arabe d’Alexandrie en 642 après J.-C. marque le début de l’hellénisation de l’Islam, qui atteint son apogée sous le califat abbasside, entre la fondation de Bagdad (762 après J.-C.) et le IXe siècle : en particulier, la Maison de la Sagesse (Bayt al-Hikma), une académie pour les scientifiques, les philosophes et les traducteurs, est fondée sous le règne du calife al-Ma’mum.
La traduction, qui devait jouer un rôle clé dans le développement de la culture islamique, est l’un des aspects les plus importants de cette dernière. C’est précisément la traduction, qui allait jouer un rôle de premier plan dans cette phase, qui avait pour mentor et figure marquante Hunayn ibn Ishaq, un Nestorien qui maîtrisait le grec, l’arabe et le syriaque, preuve de la variété et de l’ampleur des influences culturelles présentes dans le monde islamique à cette époque, en plus d’être un philosophe, le principal traducteur des œuvres de Galien et l’inventeur, tant lexicalement que syntaxiquement, de l’arabe scientifique, est considéré, bien que ce ne soit pas à proprement parler, comme le premier représentant de la médecine islamique.
Le penseur le plus important de l’âge d’or de la culture islamique est cependant Ibn-Sina, connu en Occident sous le nom d’Avicenne, qui était philosophe, mathématicien, alchimiste et médecin : dans son interminable production bibliographique, outre les célèbres Livre des remèdes et Livre des guérisons, figure en bonne place Le Canon de la médecine, un texte d’avant-garde qui, reprenant et réorganisant de manière systématique les enseignements d’Hippocrate et de Galien, deviendra le manuel médical le plus utilisé et le plus étudié au moins jusqu’au XVIIIe siècle.
Si les connaissances médicales islamiques étaient presque entièrement d’origine gréco-latine, dans le domaine de la pharmacologie, les Arabes ont absorbé des notions et des expériences provenant des nombreuses cultures, souvent éloignées, avec lesquelles ils sont entrés en contact pour des raisons commerciales . Ils se sont ainsi familiarisés avec des médicaments provenant d’Égypte, de Syrie, de Perse, d’Inde, de Chine, d’Asie du Sud-Est, de l’Himalaya et d’Afrique centrale, jusqu’alors inconnus des habitants des rives de la Méditerranée.
On attribue également aux Arabes la paternité de l’extraction de principes actifs à action pharmacologique à partir d’herbes et de plantes médicinales, grâce à une nouvelle pratique connue sous le nom d’alchimie. L’alchimie (al-kimiya), qui a vu le jour dans un environnement hellénistique en Égypte au 1er siècle de notre ère, mêlait des compétences scientifiques et “magiques”, et peut être considérée comme l’un des ancêtres de la chimie et de la chimie pharmaceutique actuelles.
Une autre caractéristique frappante de la pharmacologie arabe est l’existence de collections de “médicaments testés sur des patients” afin de cataloguer et d’apprendre les réactions physiologiques à un stimulus ou à une maladie donnée, ce qui atteste de la préférence de la thérapeutique pharmacologique sur la thérapeutique chirurgicale.
D’autre part, à cette époque, la profession de pharmacien se sépare de celle de médecin, ce qui permet l’ouverture à Bagdad, entre 699 et 765 de notre ère, des premières pharmacies au sens moderne et la compilation, pour la préparation des médicaments, de divers “antidotaires” et “dispensaires” qui joueront le rôle des futures pharmacopées.
La présence des Arabes en Europe au cours de cette phase historique souvent qualifiée de Moyen Âge a permis aux sociétés du Vieux Continent de ne pas “oublier” les acquis scientifiques des siècles précédents et, en même temps, d’enrichir leurs connaissances tant dans le domaine humaniste que thérapeutique.
Un autre élément caractéristique de la pharmacologie médiévale est la renaissance de la tériaque (ou aussi triarch), un mélange médicinal composé de divers éléments, parmi lesquels se distinguent la chair de vipère et l’opium, utilisé initialement comme antidote contre le venin de serpent, puis comme médicament considéré comme capable de résoudre presque tout type de maladie. Ce type de polypharmaceutique ante litteram était connu depuis très longtemps, et même, selon la légende, il semble avoir été inventé par Mithriades, roi du Pont au Ier siècle de notre ère, pour combattre sa peur obsessionnelle d’être empoisonné par ses rivaux53,54. Lorsque les légions de Gnaeus Pompée le Grand ont définitivement vaincu Mithriades, les médecins romains ont pris connaissance de ce remède. Plus précisément, “c’est à Andromaque l’Ancien, archiate de Néron, qu’on doit d’avoir perfectionné la recette du “Mithridate”, à laquelle il a ajouté de la chair de vipère, certain que l’utilisation de la “foire empoisonnée” augmenterait l’utilité, la vigueur et les vertus de l’antidote. C’est ainsi qu’est née la “Theriaca Magna” ou “Theriaca d’Andromaco”.
Presque disparue après la chute de l’Empire romain d’Occident, cette préparation réapparaît grâce à Avicenne, qui exalte la teriaca comme un remède universel pour traiter des coliques abdominales à tout type de fièvre, de la migraine à l’insomnie, de l’angine aux morsures de vipère et de chien, de la perte d’audition à la toux.
Au XVIe siècle, ce médicament connaît un tel succès que “dans les boutiques des apothicaires de Venise, Bologne, Naples et Rome, préparé en grande quantité, il devient un élément important de l’économie de ces villes et surtout de celle de Venise”, avec les spéculations “Tre Torri”, “Allo Struzzo” (situé à Ponte dei Barettieri), “al Paradiso”, “alli Due Mori”, “al Redentore”, “al Doge”, “al Pellegrino”, “al Pomo d’Argento”, et autres, a satisfait des demandes provenant de toute l’Italie et de l’étranger”. 58,59
Cette dimension, qui entremêle érudition et croyance, trouvera son accomplissement à la Renaissance où, à côté des grands hommes de science, les charlatans et les alchimistes sont également mis en avant60. Les XVe et XVIe siècles sont en effet peuplés d’un grand nombre de médecins accusés de charlatanisme, dont l’un des plus célèbres est le Bolonais Leonardo Fioravanti, qui commence à exercer la profession de chirurgien mais se met à dos les institutions médicales car, selon lui, elles ne sont pas en mesure de remplir leurs fonctions en raison de leur approche essentiellement théorique61. Cette accusation était fondée sur les théories du Suisse Paracelse, nom italianisé du latin (Philippus Aureolus Theophrastus Bombastus Paracelsus) du médecin, naturaliste et philosophe Philipp Theophrast Bombast von Hohenheim. Paracelse rejette la doctrine académique et les idées d’Hippocrate, de Galien et d’Avicenne, et défend l’importance de l’expérience concrète et directe de la nature. Sa médecine, qu’il appelait “spagyrique”, était basée sur l’étude de la nature, de ses lois physiques, telluriques et cosmiques, sur l’examen critique des phénomènes biologiques et sur l’utilisation de moyens chimiques pour la thérapie, en nette opposition avec la tradition hippocratique, galénique et arabe. Paracelse, à certains égards, peut être considéré comme un pionnier de la chimie pharmaceutique car il a créé de nombreuses préparations à des fins curatives avec des substances minérales (comme le mercure, le plomb, le soufre, le fer, l’arsenic, l’antimoine, le sulfate de cuivre) et végétales (comme le laudanum) qui visaient à séparer le “bon” du “mauvais”, en isolant, selon le cas, par distillation ou concentration, l’un des cinq principes actifs identifiés par lui, à savoir l’ens astrale, l’ens venemi, l’ens naturale, l’ens spiritual et l’ens dei
La figure de Paracelse est d’une importance fondamentale pour comprendre les grands changements qui se sont produits entre la fin du Moyen Âge et la Renaissance. Son ambiguïté, le fait qu’il soit à mi-chemin entre une époque et une autre, sa force de démêler les connaissances consolidées et fortes dans les académies, son incongruité entre être un homme de science et, en même temps, un alchimiste, font de Paracelse l’emblème d’une société complexe, qui reflète dans les traits stylistiques de sa personnalité les caractéristiques de toute une époque.
Les apparentes contradictions de Paracelse ne peuvent être pleinement comprises qu’en historicisant sa démarche et sa pensée à une époque où, comme nous l’avons vu, coexistaient la science et le mysticisme, la rigueur de l’observation médicale et les formules de la superstition et de la magie populaire.
A la Renaissance, deux événements importants vont conditionner la pharmacologie de manière substantielle, l’invention de l’imprimerie et l’arrivée des Européens sur le continent américain.
L’imprimerie va modifier de manière irréversible l’aboutissement du savoir, le rendant accessible à tous ceux qui peuvent comprendre l’écriture. La diffusion des livres, qui dans les siècles passés était le résultat d’un processus de production long et complexe centré sur la figure de l’amanuensis, sera simplifiée par la production en série. Le premier manuel pharmaceutique imprimé, qui traite de la préparation des potions végétales, des huiles, des sirops, des pilules et des onguents, est le Luminare Maius de Giovanni Giacomo Manlio Del Bosco, publié à Pavie le 9 avril 1494. Ce manuel était une formidable aide pratique pour les médecins et les apothicaires et, malgré ses limites, il est devenu un outil irremplaçable, “à tel point qu’il a attiré l’attention générale, dans de nombreuses villes italiennes, pendant environ un siècle”. Néanmoins, les travaux de Del Bosco ont rendu nécessaire “l’intervention d’une autorité constituée pour conférer le sceau de l’officialité à un texte qui devait être imposé dans toutes les boutiques d’apothicaires, afin de garantir la qualité et l’efficacité de ce qui était produit”.
C’est ainsi qu’est née la première pharmacopée, publiée à Florence en 1499 et intitulée Nuovo Receptario composto dal famossisimo Chollegio degli eximii Doctori della Arte et Medicina della inclita ciptà di Firenze.
La colonisation européenne de l’Amérique, à partir de 1492, va transformer en quelques décennies les structures politiques, culturelles et économiques du monde connu jusqu’alors. Du point de vue de la pharmacologie, les voyages de Christophe Colomb ont eu deux conséquences contradictoires. La première est que l’Europe a découvert de nouvelles plantes à utiliser comme médicaments, comme, par exemple, le Gialappa, le Guanaco ou Guajaco, l’Hydrastis, l’Ipercacuana, le Ratania, la Salsaparilla. La nécessité d’étudier les différentes espèces d’herbes provenant de ce qui était appelé de manière ethnocentrique le “Nouveau Monde” a conduit les universités de Padoue, Pise, Bologne et Heidelberg à créer des herbiers (collections de plantes séchées et classées) et à construire des jardins botanique. La deuxième conséquence déterminée par les nouvelles routes “ouvertes” par le navigateur génois a été que l’Europe et l’Amérique ont échangé deux infections, la variole et la syphilis, auxquelles leurs populations respectives n’avaient jamais été exposées et qui ont eu des effets pertinents non seulement sur le plan épidémiologique, mais aussi sur le plan social et économique dans les deux continents, même si ce sont sans aucun doute les populations indigènes de ce qu’on allait appeler l’Amérique latine qui ont payé le plus lourd tribut.
Dans ces années, les connaissances naturalistes, et donc aussi les connaissances pharmaceutiques et médicales, commencent à prendre l’aspect de la science au sens moderne avec Galilée, notamment grâce à la méthode expérimentale dans laquelle l’observation directe et les expériences de laboratoire (les “expériences sensibles”) sont associées à l’utilisation rigoureuse de relations mathématiques (les “démonstrations nécessaires”). Cette méthodologie, basée, comme on le sait, sur la vérification expérimentale des hypothèses, ne devait cependant trouver une confirmation que dans la seconde moitié du XIXe siècle en médecine, avec la publication en 1865 du monumental Introduction à l’étude de la médecine expérimentale de Claude Bernard, et en pharmacologie, avec la naissance des premiers médicaments de synthèse.
Les tentatives les plus intéressantes et les plus importantes pour orienter la pensée médicale du XVIIe siècle vers les nouvelles idées scientifiques galiléennes ont été faites par les écoles de iatromécanique et de iatrochimie. L’iatromécanique affirmait l’idée que l’être vivant était une machine composée de “poulies”, de “poulies” et de “tamis”, par laquelle les médicaments “agissent” en “dilatant ou en resserrant les pores, en augmentant ou en diminuant le tonus des fibres, en pénétrant plus ou moins profondément dans l’organisme avec leurs particules”. Elaborée par William Harvey, mais consolidée en tant que discipline par Marcello Malpighi81, l’hiatromécanique comptait parmi ses principaux partisans le médecin istrien Santorio Santorio (avec son livre Ars de statica medica de 1614 et ses études sur le métabolisme, thermorégulation humaine et perspiratio insensibilis) et le galiléen napolitain Giovanni Alfonso Borelli – dont l’ouvrage De motu animalium, publié à titre posthume en 1681, peut être considéré comme un bréviaire réussi de la médecine iatro-mécanique – qui pensait que “la vie est une série coordonnée de phénomènes moteurs qui peuvent être représentés et mesurés avec les outils des mathématiques”.
L’Iatrochimie, dans laquelle l’influence de la pensée de Paracelse ne peut être négligée, a été fondée par le Hollandais François de La Boë dans le but de faire remonter les maladies à des altérations chimiques, considérées comme étant à la base de tout phénomène vital : “toutes les forces du corps doivent suivre les processus chimiques de fermentation et d’effervescence”, par conséquent, “les médicaments doivent agir en diminuant l’acidité et l’alcalinité des humeurs ou en produisant des fermentations, des bouillonnements, des transformations dans le sang et dans les liquides qui irriguent les tissus”. La Iatrochimie a été le premier coup concret porté, après des siècles, à la validité des théories galéniques et a donné le départ à l’affirmation d’une nouvelle façon de comprendre la santé basée, plutôt que sur les caractéristiques du patient spécifique, sur l’observation empirique de la maladie dans un sens général, dans une tentative, au moins formelle, de récupérer un Hippocratisme des origines et non dénaturé par des auteurs ultérieurs.
Bien que la thérapie traditionnelle “individualisée” n’ait pas été entièrement mise de côté et qu’elle ait continué à être utilisée dans le contexte doctrinaire de la pathologie humorale, au cours du siècle des Lumières, les approches thérapeutiques ont progressivement abandonné la coutume de traiter chaque symptôme et chaque trouble en fonction de la condition personnelle de chaque patient, et ont évolué vers un mécanisme d’interprétation faisant appel à des classifications pathologiques (nosologies) et à des théories physiopathologiques. 86 Ainsi, alors que le médecin qui suivait une approche galénique se concentrait sur l’état du patient et ses besoins spécifiques, le médecin qui avait recours à la nosologie devait d’abord établir un diagnostic en identifiant la maladie parmi celles précédemment décrites et classées, puis, en conséquence, indiquer le traitement approprié.
Le système nosologique a eu son précurseur en Thomas Sydenham et son principal représentant en William Cullen. Assisté de son ami, le médecin et philosophe John Locke, Sydenham a probablement compilé les premiers dossiers médicaux de l’histoire, notant l’apparition, le développement et la disparition éventuelle de chaque symptôme pour chaque patient. Suivant la méthode inductive de Bacon, Sydenham transforma ses dossiers médicaux en rapports sur la maladie au sens large, les “historiae morborum”, qui contenaient des descriptions encore plus détaillées de la séquence des symptômes, mais laissaient de côté les variations observées chez les patients individuels.
Le crédit accordé à Bacon et à Sydenham par les nosologistes est évident, notamment dans les cas de Giorgio Baglivi, de François Boissier de Sauvages et, surtout, de Cullen déjà mentionné88. Le modèle thérapeutique de Cullen, qui deviendra dominant vers la fin du XVIIIe siècle, établit que, pour un traitement efficace, les remèdes doivent être adaptés au genre, à l’espèce et même à la variété de la maladie : pour cette raison, il existe quatre classes (pyrexiae, neuroses, cachexiae et locales), divisées en un total de dix-neuf ordres et cent trente-deux genres89. Le modèle de Cullen, non dénué d’ambiguïtés et de contradictions, représentait bien la situation dans laquelle se trouvaient les sciences médicinales dans ces années-là, c’est-à-dire un équilibre précaire entre la régurgitation d’une alchimie encore socialement forte et les prodromes de ce qu’on allait bientôt appeler la chimie pharmaceutique. Symptomatique de ce climat est le fait que Samuel Johnson, critique littéraire, poète et essayiste britannique, a inclus dans son célèbre Dictionnaire de la langue anglaise, la plupart des éléments chimiques connus au milieu du 18ème siècle, y compris le cobalt qui venait d’être isolé. Au sein de ce dictionnaire, l’entrée consacrée à l’antimoine, extrêmement malicieuse et à bien des égards non dénuée d’ironie involontaire, peut être considérée comme une sorte de charnière entre deux époques de la chimie. Johnson, en fait, a émis l’hypothèse que la raison du nom moderne de l’antimoine, par rapport au latin stibium, pourrait remonter “à Basil Valentine, un moine allemand qui, selon la tradition, après avoir jeté un peu d’antimoine aux cochons, a observé que la substance avait un fort effet laxatif sur eux, après quoi les animaux avaient immédiatement commencé à engraisser ; une dose de ce genre, pensait-il, pourrait également être bonne pour ses compagnons moines”. L’expérience, cependant, se déroula si mal que les moines moururent tous ; par conséquent, depuis lors, la médecine a appelé cette substance antimoine, c’est-à-dire antimonaco “.
Ce n’est qu’au début du XIXe siècle que la physiologie et la chimie abandonnent définitivement la voie alchimique et prennent les caractéristiques de véritables sciences. Les chercheurs des deux disciplines ont finalement commencé à s’appuyer sur une méthode de recherche basée sur l’expérimentation systématique réalisée d’abord en laboratoire (in vitro), puis sur des organismes vivants (in vivo). Ainsi, la physiologie peut étudier le fonctionnement du corps dans des conditions normales et pathologiques, tandis que la chimie peut sélectionner les principes actifs de préparations obtenues en grande partie à partir d’herbes et de plantes.
Un premier signe tangible de ce nouveau cours, qui changera à jamais l’histoire de la médecine, sera l’identification des premiers vaccins de conception moderne, dont l’utilisation à grande échelle améliorera, et sauvera, l’existence de millions d’individus avec des répercussions sociales évidentes et positives. Tout commence en 1796, lorsque Edward Jenner expérimente, à partir de la variole de la vache, une préparation capable de garantir une résistance spécifique contre une certaine maladie infectieuse. Jenner avait en effet remarqué que les trayeurs qui avaient contracté la variole de la vache ne tombaient pas malades de la version humaine de la même maladie.
Le médecin et naturaliste britannique, supposant que l’infection par la variole de la vache pouvait offrir une certaine forme de protection contre celle de l’homme, prépara une substance liquide contenant le virus de la variole de la vache qu’il injecta ensuite à un garçon anglais de huit ans, James Phipps, en utilisant une épine comme seringue. Après quelques semaines, afin de vérifier son efficacité, il a administré à Phipps une dose de variole humaine qui, cependant, n’a pas activé la maladie car le virus bovin inoculé précédemment avait stimulé la production d’anticorps et immunisé l’enfant. Le résultat exceptionnel obtenu par Jenner, a ouvert la voie dans les décennies suivantes à de nouvelles recherches qui ont permis à Robert Koch et Louis Pasteur de créer des vaccins contre l’anthrax et la rage.
Les produits pharmaceutiques ont fait d’énormes progrès au cours de ces années ; les relations entre la dose et l’effet, et celles entre la structure et l’activité pharmacologique, ont commencé à être reconnues. Giovanni Semmola, dans son Traité de pharmacologie et de thérapie générale de 1853, traite de l’absorption des médicaments, en partant de l’hypothèse que non seulement le médicament est capable de modifier l’organisme, mais que l’organisme influence également l’activité du médicament.
C’est également à cette époque que l’on comprend que, dans les drogues végétales, l’activité médicinale est due à un ou plusieurs principes actifs qui, concentrés dans les graines, les écorces, les feuilles, les fleurs et les racines, sont synthétisés par la plante au cours d’un cycle biologique annuel ou pluriannuel. Dans ce but, de nombreux constituants, tels que les glycosides et les alcaloïdes, sont isolés à l’état pur : ces derniers, justement, sont à considérer, selon Egidio Pollacci, comme “l’une des plus belles conquêtes scientifiques de la première moitié du XIXe siècle”.
En fait, le moment était venu pour la naissance de la pharmacologie en tant que science autonome. Ce sera Rudolf Buchheim et son disciple Oswald Schmiedeberg qui la fonderont, en se consacrant à la corrélation entre la structure chimique des substances et leur efficacité en tant que médicaments. Schmiedeberg, en particulier, s’est attaché à regrouper tous les composés capables d’exercer une action pharmacologique similaire, jetant ainsi les bases de la classification scientifique des médicaments.
Au XIXe siècle, la pharmacologie a également joué un rôle crucial dans le développement de la chirurgie, qui a pu bénéficier des découvertes de l’anesthésie et de l’antisepsie : William Green Morton, grâce à l’utilisation d’un éther, a réussi à endormir un patient pour la première fois en 1846 lors d’une opération
De différentes manières et sous différentes formes, Ignác Semmelweis (avec l’hypochlorite de calcium en 1847) puis – inspiré par les contributions de Louis Pasteur – Joseph Lister (avec l’acide carbonique en 1865) ont réussi à éradiquer les conséquences des agents pathogènes dans les salles d’opération.
Le début de la fabrication de médicaments par synthèse chimique – c’est-à-dire produits à partir de substances non plus extraites de plantes ou d’animaux, mais obtenues artificiellement en laboratoire – a provoqué une révolution qui a affecté toute la société du XIXe siècle106. Elle a déclenché, en fait, un processus d’industrialisation de la production pharmaceutique qui, d’une part, a transformé le médicament en “un remède innovant pour son énorme capacité curative et pour sa large et facile disponibilité”, et, d’autre part, en a fait une “marchandise”, “capable de déterminer un profit économique et en tant que telle soumise aux règles rigides du marché commercial”.
Entre 1880 et la Première Guerre mondiale, l’industrie pharmaceutique a connu une période de croissance extraordinaire, surtout en Allemagne et en Suisse, pays où de nombreux facteurs allaient s’avérer décisifs : ” la présence d’une importante industrie chimique, l’industrie des colorants, qui a conduit à la découverte des Arsenobenzoles et des Sulphonamides, (…) la disponibilité de capitaux importants et un esprit d’entreprise concret en ce qui concerne le développement des médicaments “. 109 Certaines de ces réalités industrielles, comme les allemandes Bayer (1863), BASF (1865) et Schering (1871) ou les suisses CIBA (1884), Sandoz (1886) et Hoffman La Roche (1894), allaient devenir de célèbres entreprises multinationales qui existent encore aujourd’hui. En Italie, les entreprises pharmaceutiques sont nées de la transformation des laboratoires des anciennes pharmacies, par exemple, à Turin par Giovanni Battista Schiapparelli (1823), et à Milan par Carlo Erba (1853), Ludovico Zambeletti (1868) et Roberto Giorgio Lepetit (1864).
La logique du profit s’est ainsi mêlée à celle de la recherche, permettant la naissance de nombreux nouveaux médicaments. Le premier véritable médicament synthétique utilisé en clinique et produit par l’industrie pharmaceutique fut l’acétofénétidine qui, connue sous le nom de phénacétine, précurseur du paracétamol actuel, fut breveté et introduit sur le marché en 1888 par Bayer. Dix ans plus tard, Bayer commercialisa également le deuxième médicament synthétique, l’acide acétylsalicylique sous le nom d’aspirine. En 1903, Emil Hermann Fischer et Joseph von Mering, exploitant l’acide barbiturique qu’Adolf von Baeyer avait synthétisé en 1863 à partir d’urée et d’acide malonique, ont préparé le Barbital qui, vendu sous le nom de Veronal, a été largement utilisé jusqu’au milieu du 20e siècle, lorsqu’il a été remplacé par les benzodiazépines.
En 1909, Paul Ehrlich créa un composé arsenical, le Salvarsan, qui fut le premier véritable remède pour le traitement de la syphilis, et jusqu’à l’avènement de la pénicilline, le seul médicament pour combattre cette maladie. Le Salvarsan était cependant important, plus que pour ses effets thérapeutiques, pour la qualité des études qui ont permis sa création et qui ont eu des développements ultérieurs importants. En particulier, Ehrlich avait compris qu’il existait une affinité chimique qui régulait les processus biologiques, de sorte que certaines substances (qu’il appelait “balles magiques”) pouvaient neutraliser certains micro-organismes sans causer de dommages à la structure qui les abritait. Au cours de ses expériences de coloration sélective des cellules du système immunitaire, Ehrlich avait testé les effets du colorant bleu de méthylène aniline sur le plasmodium de la malaria, en utilisant l’examen de coloration bactérienne mis au point par le pathologiste danois Hans Joachim Christian Gram en 1884. Le prix Nobel allemand a ensuite concentré son attention sur Treponema pallidum, la bactérie de la syphilis identifiée en 1905 par Fritz Schaudinn et Paul Erich Hoffmann. Après de longues et patientes recherches en laboratoire, avec la préparation, qui était similaire à celle des colorants azoïques, mais avec de l’arsenic au lieu de l’azote, le Salvarsan (jeu de mots pour la contraction de “l’arsenic qui sauve”) est né, le premier médicament de chimiothérapie à toxicité acceptable actif contre la syphilis.
Bien que, comme mentionné ci-dessus, les résultats obtenus sur la syphilis par les arsénobenzoles n’aient pas été brillants, les idées d’Ehrlich ont représenté une étape fondamentale pour la naissance de la pharmacothérapie antimicrobienne et pour la formulation du concept de récepteur. En effet, à partir de ses intuitions, dans les années trente, plusieurs scientifiques se sont concentrés sur les effets antibactériens des groupes sulfanilamide contenus dans certains colorants industriels, alors largement utilisés pour leur propriété de se fixer de manière intense et sélective aux fibres de laine et de soie des tissus. Ces efforts ont permis à Gerhard Domagk, chercheur chez Bayer, d’identifier en 1934 l’activité antibactérienne d’un colorant rouge (p-sulfanyl chrysoidine), qui a reçu le nom de Prontosil Rubrum (Prontosil Red), capable de bloquer la multiplication des pneumocoques, responsables de la pneumonie, des streptocoques et des méningocoques.
La véritable percée, cependant, a eu lieu avec la découverte de la pénicilline. En 1929, Alexander Fleming remarque, par hasard, que dans un milieu de culture où des staphylocoques avaient été semés, la chute involontaire d’une spore avait créé une colonie d’une moisissure commune, Penicillium notatum, autour de laquelle les staphylocoques ne se développaient pas. Fleming comprit que ce phénomène était dû à l’activité antibactérienne exercée par la substance produite par la moisissure, qu’il appela pour cette raison pénicilline.121 La pénicilline, cependant, ne fut isolée qu’en 1940 grâce à Ernst Boris Chain et Howard Walter Florey, qui démontrèrent sa capacité in vivo, ce qui permit le début de la production industrielle. Ces études ont valu à Fleming, Chain et Florey le prix Nobel de médecine et de physiologie en 1945.
Quelque quarante ans avant que Fleming ne trouve la colonie de Penicillium notatum dans une culture de staphylocoques, c’est-à-dire en 1893, un médecin de la marine italienne, Vincenzo Tiberio, “avait déjà formulé l’hypothèse, confirmée ensuite par les résultats des recherches expérimentales qu’il avait menées (…) et documentée dans une étude, du pouvoir destructeur de certaines moisissures sur les bactéries”. Tout a commencé dans la maison de Via Zanardelli à Arzano, une ville près de Naples, où vivait Tiberio et où il y avait un puits pour recueillir l’eau de pluie utilisée pour la boisson. L’humidité de l’endroit faisait qu’une épaisse couche de moisissure se développait souvent sur le bord de la citerne, qui était périodiquement enlevée. Tibère a remarqué que chaque fois que le puits était nettoyé, les habitants de la maison souffraient de gastro-entérite, alors que cela ne se produisait pas pendant les périodes où la moisissure était présente. Il a deviné que ces moisissures avaient une action bactéricide et chimiotactique, il les a donc isolées, a testé leur effet bénéfique, à la fois in vitro et in vivo sur différents cobayes, et a préparé un médicament expérimental aux effets antibiotiques. En janvier 1895, Tiberio publia dans la revue universitaire napolitaine Annali di Igie-ne sperimentale les résultats de ses recherches dans un article intitulé Sugli estratti di alcune mole. Malheureusement pour Tiberio, l’article était en italien et n’avait pratiquement aucune diffusion à l’étranger, et de toute façon ses collègues italiens considéraient ses résultats comme le fruit de coïncidences fortuites et sans intérêt scientifique. En réalité, alors que Fleming avait découvert le moule de la pénicilline par hasard, Tiberio y était arrivé en connaissance de cause et, par rapport au prix Nobel anglais, avait en fait préparé un médicament expérimental, fermant ainsi le cycle de la recherche.
A certains égards, l’histoire de Giuseppe Brotzu est très similaire à celle de Vincenzo Tiberio. Brotzu, directeur de l’Institut d’hygiène de l’université de Cagliari, avec son collaborateur Antonio Spanedda, a découvert les céphalosporines à la fin des années 1940. Leurs intuitions sont nées de l’observation des baigneurs de la zone de Su Siccu, à Cagliari, qui, bien qu’entrés en contact avec une eau fortement polluée, n’ont contracté aucune infection de salmonellose, de typhus ou de paratyphus. Les deux chercheurs ont isolé une moniliacée du genre Cephalosporiumin, identifiée par la suite comme Cephalosporium acremonium, dont ils ont tiré une préparation ad hoc qu’ils ont d’abord testée sur eux-mêmes, puis administrée à quelques patients souffrant de salmonellose, admis à l’hôpital San Giovanni di Dio de Cagliari. La préparation a donné d’excellents résultats sans déclencher d’effets secondaires importants, mais tout cela n’a pas suffi à obtenir des fonds des principales institutions de recherche italiennes pour poursuivre les études. Le médecin sarde décide donc d’envoyer des échantillons de ses cultures à Florey, par l’intermédiaire d’un ancien médecin britannique de l’armée d’occupation en Sardaigne. Dans les laboratoires de Florey, un groupe dirigé par Edward Panley Abraham et Guy Newton extrait et purifie différentes substances entre 1951 et 1961, dont la céphalosporine C, fondatrice d’une nouvelle génération d’antibiotiques.
Si les recherches de Tiberio n’ont pas reçu la considération qu’elles méritaient certainement, Brotzu a au moins été reconnu comme l’auteur de la découverte, mais seulement en 1970. Entre 1950 et 1970, l’industrie pharmaceutique a investi d’énormes sommes d’argent et des technologies de plus en plus avancées pour identifier et produire de nouveaux antibiotiques. Cet incroyable effort a conduit au développement d’antibiotiques tels que l’érythromycine (Streptomyces arithreus), la néomycine (Streptomyces fradice), la vancomycine (Streptomyces orientalis) et la rifampicine (Amycolaptosis rifamycinica). Parmi ceux-ci, la rifampicine (connue aux Etats-Unis d’Amérique sous le nom de rifampin) mérite une brève mais nécessaire investigation. En 1965, au cours de recherches systémiques menées par un groupe de scientifiques dirigé par Piero Sensi pour les laboratoires de recherche Lepetit à Milan, un micro-organisme a été isolé à partir d’un échantillon de sol de la Côte d’Azur, qui a d’abord été considéré comme appartenant au genre Streptomyces, puis reclassé comme Nocardia. Le produit semi-synthétique qui en a résulté a été commercialisé en 1968 sous le nom de marque Rifadin et s’est immédiatement avéré très efficace dans le traitement de la lèpre, des légionelles et surtout de la tuberculose. De nombreuses preuves cliniques ont montré que la rifampicine, qui était initialement utilisée comme un médicament alternatif pour compléter les traitements conventionnels, lorsqu’elle était utilisée comme médicament de premier choix en association avec d’autres agents antituberculeux, et en particulier avec l’isoniazide, donnait des résultats surprenants par rapport aux thérapies précédentes, tant pour le temps de guérison beaucoup plus court que pour la fréquence moindre des rechutes. La commercialisation de la rifampicine a probablement été l’un des sommets les plus élevés et les plus prestigieux de la pharmacie italienne dans les années 1960, une période où l’Italie connaissait, parallèlement au soi-disant “miracle économique”, un authentique “miracle pharmacologique et pharmaceutique “.
Au cours du XXe siècle, le médicament est donc devenu un objet industriel qui, s’il permet de guérir de nombreuses personnes et de nombreuses maladies, enrichit en même temps ceux qui le produisent. D’autre part, comme nous l’avons vu, à la fin du XIXe siècle, les produits pharmaceutiques avaient déjà acquis le statut de marchandise et étaient donc soumis à la logique du marché et du profit qui ne respectait pas toujours les besoins et les droits du consommateur-patient. Et, en effet, à côté des grands triomphes, de terribles tragédies n’ont pas tardé à se produire, résultat d’erreurs ou, plus souvent, d’une superficialité “commode”. Entre septembre et octobre 1937, une préparation liquide d’un sulfamide – Elixir Sulfanilamide, produit par la Samuel Evans Massengill Company, une société basée à Bristol, Tennessee, qui contenait un véhicule toxique, le diéthylène glycol (un composé de base des liquides antigel) – a causé la mort d’au moins cent cinq personnes dans quinze États de l’Union. Mais l’épisode le plus grave est sans doute lié à la thalidomide, un médicament à action hypnotique qui, s’il est pris pendant la grossesse, provoque une malformation très grave chez les enfants à naître, la phocomélie. Tout a commencé lorsque l’industrie ouest-allemande Chemie Grünenthal a déposé et obtenu en 1954 le brevet du Contergan, un anti-nauséeux et sédatif à base de thalidomide. Grâce à une campagne de marketing impressionnante et au fait que, dans la République fédérale d’Allemagne de l’époque, le Contergan pouvait être acheté sans ordonnance, ce médicament a connu un tel succès qu’il a été décidé de le distribuer et de le vendre dans quarante-six pays. En 1959, des études européennes ont montré de possibles effets neuropathologiques liés à l’utilisation de la thalidomide et, la même année, Frances Kelsey, une pharmacologue travaillant pour la Food and Drug Administration (FDA), malgré les pressions de la société pharmaceutique, a refusé la licence de commercialisation du médicament aux États-Unis. L’année suivante, lors d’un congrès pédiatrique à Düsseldorf, Widukind Lenz, commentant deux cas cliniques de malformations congénitales des membres, a suggéré que ces malformations pourraient être liées à l’utilisation de la thalidomide pendant la grossesse. Lenz a lancé une série d’enquêtes qui ont abouti à un rapport virulent contre le médicament auquel on attribue quelque dix mille cas de malformations dans le monde. Le 2 décembre 1961, la thalidomide a été retirée du marché en Grande-Bretagne, neuf mois plus tard en Italie, puis en peu de temps dans tous les autres pays où elle était commercialisée.
L’affaire de la thalidomide a profondément marqué la conscience populaire de l’époque et a contraint les autorités sanitaires à revoir et à édicter de nouvelles réglementations visant à une expérimentation pharmacologique et clinique plus correcte des médicaments, afin de garantir l’absence d’effets indésirables et secondaires graves et l’efficacité thérapeutique réelle des médicaments mis sur le marché.138 Ainsi, aux États-Unis d’Amérique, le 10 octobre 1962, le président John Kennedy a signé le “Kefauver Harris Amendment” qui modifiait le Federal Drug and Cosmetic Act, en introduisant les exigences éthiques de l’expérimentation clinique et le protocole randomisé avec des groupes parallèles en “simple ou double aveugle”.
Cette règle, née à des fins réglementaires, a été en fait adoptée par la communauté scientifique pour les démonstrations d’efficacité et a favorisé un changement substantiel des protocoles toxicologiques, intégrés par la pharmacocinétique et la toxicocinétique. De même, le 26 janvier 1965, le Conseil de la Communauté économique européenne (CEE) de l’époque a adopté la directive n° 65 “concernant le rapprochement des dispositions législatives et administratives relatives aux spécialités pharmaceutiques”, qui allait devenir une référence essentielle pour toute la législation sur les produits pharmaceutiques dans les pays qui, après quelques décennies, allaient faire partie de la Communauté européenne. Ce règlement, qui alignait l’Europe sur ce qui avait déjà été fait aux États-Unis d’Amérique, établissait que la documentation requise pour obtenir l’autorisation de mise sur le marché d’un nouveau médicament devait consister en “des tests physico-chimiques, biologiques ou microbiologiques ; des tests pharmacologiques et toxicologiques ; des tests cliniques”.
L’évolution de cette législation a conduit à la promulgation d’un code commun à tous les États membres de l’UE et à la création d’une agence réglementaire communautaire, l’EMEA (Agence européenne pour l’évaluation des médicaments), appelée depuis 2005 EMA (Agence européenne des médicaments), qui a stimulé la naissance d’agences réglementaires nationales.
Pourtant, il faut souligner que l’étonnant développement de la science, de la technologie et, en général, des techniques, qui avait fait du XIXe siècle un protagoniste de l’histoire, allait prendre au cours du XXe siècle des formes et des proportions telles qu’elles allaient affecter la vie des individus comme jamais auparavant. Et ce ne sont pas seulement les objectifs extraordinaires atteints qui ont marqué le rythme par rapport aux époques précédentes, mais aussi le temps extrêmement court entre une étape et la suivante. Le vingtième siècle, en revanche, peut être considéré comme une ligne de partage des eaux entre un monde qui disparaît et un autre projeté vers un avenir toujours plus proche et, dans toutes ses significations, présent. La pharmacologie du vingtième siècle ne fait pas exception et réalise, comme cela a déjà été partiellement mentionné dans les pages précédentes, une incroyable série de succès qui amélioreront la vie et, surtout, les chances de survie de l’humanité. Il suffit de dire que “les sulfamides, la pénicilline, l’insuline, les vitamines, les anticoagulants ont été découverts dans la première moitié de ce siècle, tandis que dans les années qui ont suivi la Seconde Guerre mondiale, de nouveaux antibiotiques ont été introduits dans la thérapie, les médicaments contre l’hypertension artérielle, les médicaments contre les maladies métaboliques-dégénératives, telles que l’athérosclérose, et contre leurs complications (thrombose coronaire et cérébro-vasculaire), les nouveaux médicaments anticancéreux, ainsi que les médicaments contre les troubles mentaux graves tels que la psychose. On a également découvert des “inhibiteurs de la pompe à protons”, comme l’oméprazole, capables de bloquer ou de réduire la sécrétion d’acide gastrique et donc efficaces dans le traitement de l’ulcère gastro-duodénal et de l’œsophagite par reflux”. Tous ces nouveaux médicaments contribuent à une augmentation considérable de la durée de vie moyenne des individus. En ce sens, si l’Italie est utilisée comme un cas paradigmatique des améliorations survenues dans les pays dits occidentaux en matière d’espérance de vie à la naissance, il faut rappeler que si en 1861 les enfants du Royaume d’Italie avaient une espérance de vie à la naissance de vingt-neuf/trente ans, en 2015 ce même indicateur s’élevait à 80,1 ans pour les hommes et 84,6 ans pour les femmes.
Cependant, la découverte qui distinguera le “petit siècle” est sans aucun doute celle de l’acide désoxyribonucléique (ADN), dont la structure moléculaire et les relations existant entre elle et les mécanismes liés à la transmission du patrimoine génétique ont été décrites en 1953 par Harry Francis Crick et James Dewey Watson, qui ont obtenu le prix Nobel neuf ans plus tard pour ces mêmes recherches.
L’identification de l’ADN a eu une importance qui allait bien au-delà de l’explication de la structure et de la fonctionnalité de la molécule, puisqu’elle a été le déclencheur d’une série de nouvelles connaissances qui allaient s’avérer significatives tant en termes scientifiques qu’en termes de leurs effets, non seulement en termes de médecine et de santé, sur les sociétés humaines. En ce sens, la technologie la plus influente issue de la découverte de Watson et Crick est peut-être le génie génétique.
Le génie génétique, qui a vu le jour au début des années 1970 grâce à Paul Berg, Herbert Boyer et Stanley Cohen, peut être brutalement décrit comme une opération de “découpage, couture et copie”. Plus précisément, le gène est d’abord excisé de l’ADN de l’organisme dont il provient, puis “cousu” dans une nouvelle molécule d’ADN, c’est-à-dire le vecteur, qui le transporte vers l’organisme hôte. Enfin, il est copié de nombreuses fois, c’est-à-dire cloné, au fur et à mesure que l’organisme hôte se reproduit.
Ce processus d’acquisition d’un gène étranger en laboratoire n’est en fait pas si innovant, à certains égards, “chaque fois qu’un individu tombe malade avec un rhume, il acquiert – contre sa volonté – des gènes viraux étrangers”. Ce qui distingue le génie génétique de ce qui se passe dans la nature, c’est le fait que ce transfert peut avoir lieu d’une manière qui est, au moins en partie, contrôlable.
En transférant un ADN étranger dans un animal, une plante ou un microbe, on obtient un organisme transgénique. Ces nouvelles formes de vie, qui sont de plus en plus présentes dans différents secteurs de la vie quotidienne, ont posé un sérieux problème éthique. En effet, bien qu’elles ne possèdent dans leur ADN qu’un seul gène d’une espèce étrangère, elles ont des génomes différents de toutes les créatures qui ont émergé au cours de ce qui est considéré comme l’évolution naturelle des espèces qui vivent sur Terre. Le degré de radicalité de cette différence dépend du point de vue avec lequel on interprète la question : “on peut soutenir que les êtres humains ont toujours “interféré” avec cette évolution, avec le développement des techniques traditionnelles de croisement des plantes et des animaux, et que le génie génétique n’est rien de plus qu’une technologie plus sophistiquée pour effectuer des croisements. Ou bien on peut se ranger du côté de ceux qui considèrent le génie génétique avec une profonde suspicion pour sa capacité à faire tomber les barrières entre les espèces.”.
Le premier cas d’application commerciale du génie génétique dans le domaine pharmaceutique s’est produit avec l’introduction du gène de l’insuline dans une bactérie intestinale commune, Escherichia coli, qui a effectivement marqué le début de la naissance des médicaments biotechnologiques. Les médicaments biotechnologiques ne sont pas le résultat d’une synthèse chimique mais, grâce à la technique de l’ADN recombinant, ils exploitent les mécanismes moléculaires intrinsèques de la duplication du matériel génétique d’un organisme. Cette technique consiste à assembler (“combiner”, précisément) des gènes d’origines différentes et à les insérer dans un micro-organisme. Par exemple, avec l’insertion du gène humain de synthèse de l’insuline dans le génome de la bactérie Escherichia coli, il a été possible de produire artificiellement de l’insuline humaine pour la première fois. Avant cette époque, l’insuline était extraite chimiquement des glandes pancréatiques des chevaux et des porcs provenant des abattoirs et, pour cette même raison, elle pouvait induire des réactions allergiques chez l’homme. La production d’insuline avec la technologie de l’ADN recombinant, qui sera commercialisée par la société américaine Genetech à partir de 1982, a assuré non seulement une réserve presque infinie de cette substance, mais aussi de grands avantages sur le plan thérapeutique : l’insuline obtenue de cette manière est identique à celle produite par l’organisme et présente donc un risque moindre de réactions indésirables.
Après l’insuline, de nombreuses substances ont été créées avec la technique de l’ADN recombinant qui se sont avérées fondamentales en thérapie (pensez, par exemple, à l’hormone folliculo-stimulante ou à l’érythropoïétine), il n’est donc pas surprenant qu’en 2000, les médicaments biotechnologiques représentaient moins de 10% des médicaments disponibles, alors que quinze ans plus tard, ils ont acquis un espace significatif avec une tendance à la croissance constante.
L’étude des génomes et de leurs mécanismes biologiques représente donc une frontière fertile qui, à l’avenir, conditionnera non seulement le destin de la pharmacologie, mais aussi celui de nombreux autres secteurs de la connaissance, qu’ils soient médicaux et biomédicaux, sociaux ou politiques.161 En ce qui concerne la pharmacologie, la plupart des investissements humains et financiers réalisés dans ce domaine se concentrent sur les effets des médicaments générés sur une base moléculaire et sur le potentiel de ces thérapies conçues sur la base de la connaissance de la structure du matériel génétique. En particulier, “les variations de la séquence d’ADN d’un individu à l’autre ont introduit le concept d’empreinte génétique”, qui devrait permettre de réaliser “des études prédictives, c’est-à-dire capables d’identifier le risque réel de développer une pathologie donnée”. D’autre part, déjà avec les techniques actuelles de séquençage génomique, il est possible de définir l’héritage génétique des maladies et de comprendre la modulation de l’environnement sur le génome chez différents individus, et donc de mettre en œuvre une certaine ” personnalisation ” de la médecine et des thérapies : ” le séquençage génétique à grande échelle et la bioinformatique permettent l’analyse massive de données liées à des informations sur les modes de vie au moyen d’algorithmes “. Sur la base de l’analyse d’énormes quantités de données (corrélation entre le séquençage génétique, le mode de vie et l’environnement), différents facteurs de risque et types de degrés de susceptibilité aux maladies sont identifiés en comparant les personnes en bonne santé et les malades. Les algorithmes permettent de prédire les maladies ou leur évolution. Cependant, cette nouvelle approche nécessite une interaction essentielle entre les chercheurs (biologistes, généticiens, médecins, pharmacologues) et les physiciens, mathématiciens, ingénieurs et informaticiens.”
Les grands résultats obtenus par la recherche scientifique au cours des dernières décennies ont, une fois de plus, pour contrepoids les contradictions exprimées par un système économique, désormais omniprésent, dominant et mondialisé, qui, à ce jour, n’a pas cessé de caractériser la dynamique de la sphère drogue-santé. Emblématique, en ce sens, est la large utilisation des antibiotiques par exemple, en 2017, les antimicrobiens généraux à usage systémique représentaient la troisième catégorie thérapeutique de dépenses publiques, pour un montant de près de 3. 486 millions d’euros (soit 57,54 euros par habitant) – qui, si d’une part a permis de soigner des millions de malades atteints d’infections potentiellement mortelles, d’autre part a conduit à leur utilisation excessive et inappropriée, provoquant l’émergence de pathogènes résistants aux antibiotiques et la nécessité conséquente de devoir créer de nouveaux antibiotiques plus puissants, dans un jeu ascendant à l’issue encore incertaine.
Au terme de ce bref tour d’horizon – qui n’est certes pas exhaustif, mais dont le but premier est de susciter de nouvelles études plus approfondies sur l’histoire du médicament – on ne peut manquer de souligner que la pharmacologie est un savoir très ancien et en même temps très moderne, qui combine aujourd’hui encore des pratiques qui se perdent dans la nuit des temps avec des approches hyper-technologiques. Des sociétés primitives, dans lesquelles la figure du pharmacien ne faisait qu’un avec celle du médecin, du prêtre et du philosophe, nous sommes arrivés à l’époque contemporaine où la pharmacologie n’est pas seulement une science autonome aux frontières clairement reconnaissables, mais une discipline qui, à son tour, se divise en plusieurs branches, chacune ayant son importance décisive.
Des plus “traditionnelles”, comme la pharmacologie systémique, la pharmacocinétique ou la toxicologie, de nouvelles trajectoires se sont progressivement dessinées, allant de la biotechnologie à la pharmacogénétique, de la pharmacogénomique à la pharmacoépidémiologie, de la pharmacoéconomie à la pharmacovigilance, dans un effort continu de dépassement jour après jour, année après année. Presque comme pour confirmer l’intuition de Weber selon laquelle une invention-découverte scientifique ne peut être considérée comme véritablement “réussie” que lorsqu’elle est, en peu de temps, dépassée par de nouvelles connaissances qui ont ainsi rapidement vieilli la découverte initiale : “tel est le destin, ou plutôt le sens du travail de la science (…) : tout “succès” scientifique doit impliquer de nouvelles questions et prétendre le plus tôt possible à être dépassé et vieilli”.
Histoire de la médecine
L’évolution de la médecine des origines à nos jours
L’histoire de la médecine a des origines millénaires ; la pratique de l’auto-soin est née avant l’homme, avec l’instinct des animaux d’utiliser les plantes et les minéraux pour se soigner et la capacité des plantes à se défendre contre les parasites en distinguant des substances à potentiel curatif.
Les soins du corps, compris dans un sens thérapeutique, se sont développés et ont évolué avec l’homme ; à l’origine, ils étaient basés sur l’instinct, mais au fil des siècles, ils sont devenus l’objet d’études et d’analyses, visant principalement à identifier les causes de la maladie.
Chamans, prêtres, sorciers et hommes-médecine, les profils qui ont couvert le rôle de prendre soin de la santé des gens, jetant les bases de cette frontière si nette qui, aujourd’hui encore, sépare ceux qui guérissent de ceux qui reçoivent le remède.
Entrons dans le vif du sujet et tentons de reconstituer un bref excursus historique à travers les principales étapes de l’évolution de la médecine.
La première forme de science médicale remonte au cinquième siècle avant Jésus-Christ et est liée à la figure d’Hippocrate, le médecin grec qui a donné son nom au serment prononcé aujourd’hui par les futurs médecins.
Les premières élaborations médico-scientifiques de la période hellénique sont liées au “père de la médecine” ; elles décrivent en détail les principaux symptômes des maladies et leur évolution.
Selon les études d’Hippocrate, les maladies ont une origine naturelle due au déséquilibre entre les quatre humeurs qui régissent l’organisme (sang, flegme, bile jaune et noire).
De cette hypothèse découle la “vis medicatrix naturae”, qui signifie littéralement “force de guérison de la nature”, c’est-à-dire la croyance que le corps possède en lui-même les moyens de se guérir.
Selon la théorie d’Hippocrate, l’évolution d’une maladie exprime les tentatives de l’organisme de résoudre spontanément le problème physique et donc de se guérir.
La médecine grecque s’est donc éloignée des croyances religieuses et des pratiques magiques pour s’orienter vers une méthodologie plus rationnelle et empirique.
Les Romains, contrairement aux Grecs, n’ont pas écrit d’histoire médicale particulièrement pertinente ; la plupart des traditions ont été rapportées de Grèce.
Notoirement méfiant à l’égard de l’influence grecque, le peuple romain n’avait pas une grande estime pour la médecine, dont la fonction était essentiellement “reléguée” aux questions d’hygiène publique et de soins de santé au sein de l’armée.
Outre les saignées, qui étaient considérées à l’époque comme la panacée pour tous les maux, les Romains ont expérimenté une forme primitive de chirurgie.
La découverte de certains instruments “médicaux” lors de fouilles archéologiques témoigne du fait que les premiers hôpitaux, ainsi que les premiers traitements gynécologiques, sont nés dans la Rome antique.
Une autre figure qui a dominé le domaine de la médecine, après Hippocrate et jusqu’à la Renaissance, est Galien, médecin des gladiateurs de Pergame et plus tard de Marc-Aurèle.
La naissance des spécialisations est liée à ses études ; il a innové dans le domaine du diagnostic, du pronostic et de la thérapie, en concentrant les phases exclusivement sur l’organe ou les organes malades.
Au fil des siècles, l’élargissement/approfondissement des connaissances scientifiques, la découverte du pouvoir thérapeutique-pharmacologique de certaines substances naturelles et le perfectionnement de la chirurgie jusqu’à l’augmentation mammaire ont conduit à remodeler le concept de médecine.
L’histoire de la qualité des médicaments
Au début du XIXe siècle, lorsque les gens avaient besoin de médicaments, ils se rendaient à l’apothicairerie locale, où le pharmacien préparait une préparation médicale à partir de plantes et de minéraux collectés à la main. Cela pouvait sembler un peu comme regarder le barman d’un café mélanger les ingrédients de notre boisson préférée du matin. Mais les conséquences potentielles d’ingrédients médicinaux incohérents ou de mauvaise qualité, ou d’une erreur de la personne derrière le comptoir, pouvaient être bien plus graves qu’une tasse de café moins délicieuse. Il y a deux cents ans, les types et les quantités d’ingrédients médicamenteux étaient très variables. Les patients recevaient parfois trop ou trop peu de médicaments. Il y avait souvent plusieurs noms pour le même médicament. Et les médicaments portant le même nom n’avaient pas toujours les mêmes propriétés. Souvent, des “remèdes miracles” sont colportés lors de spectacles itinérants. Les professionnels de la santé faisaient de leur mieux, mais, dans certains cas, le traitement pouvait être plus dangereux que la maladie. Dans les années qui ont suivi la Révolution, les gens sont devenus de plus en plus malades à mesure que la pauvreté augmentait et que l’eau et l’air étaient de plus en plus pollués. La médecine traditionnelle est devenue de plus en plus inefficace. Les gens ont commencé à se tourner vers la médecine non conventionnelle et les personnes qui adoptaient ces méthodes, comme les sages-femmes, les guérisseurs populaires et les chamans amérindiens. Les tensions se multiplient entre les médecins qualifiés et le public américain à la recherche de remèdes plus efficaces1.
La pharmacopée de 1820
Cette méfiance croissante à l’égard de la médecine traditionnelle est l’un des facteurs à l’origine de l’une des périodes d’inventions médicales les plus révolutionnaires du XIXe siècle, ainsi que du développement de la médecine moderne en général. S’inspirant de cette tension, Lyman Spalding, médecin et professeur de New York, s’est alarmé lorsqu’il a constaté que des médicaments incohérents et de mauvaise qualité menaçaient la santé de ses patients. Avec l’aide de Samuel Mitchill, médecin, naturaliste et homme politique américain de New York, il a convaincu d’autres médecins de se réunir en janvier 1820 au Capitole des États-Unis pour former la United States Pharmacopeia. Ils ont mis en place des normes de qualité des médicaments qui protégeraient la santé du public. Reflétant l’esprit de la jeune nation, le groupe ne ferait pas partie du gouvernement, mais resterait une organisation indépendante qui s’appuierait sur les dernières avancées scientifiques pour instaurer la confiance dans les médicaments. Le groupe s’est réuni pour réviser en permanence les normes scientifiques, qui ont été mises à la disposition du public – un exemple précoce de l’utilisation du “crowd sourcing” pour créer un produit “open source” au profit du public.
Ils ont créé une liste bien définie et clairement décrite des substances et préparations médicinales les mieux comprises de l’époque, que les médecins, sages-femmes et autres professionnels de la santé de tous les États-Unis d’Amérique nouvellement créés pouvaient utiliser pour préparer des médicaments de manière cohérente et établir leur indépendance vis-à-vis de la Grande-Bretagne. Cette première édition de l’U.S. Pharmacopeia a été rédigée en anglais et en latin, ce qui la rendait largement accessible, et a été imprimée à bas prix pour la rendre facilement abordable.
D’une ressource à une autorité en matière de qualité des médicaments
L’USP est passée du statut de ressource à celui d’autorité, lorsque le gouvernement fédéral a commencé à s’affirmer en tant que superviseur de la qualité des médicaments. La pharmacopée moderne a été reconnue officiellement pour la première fois avec la loi sur l’importation des médicaments de 1848, promulguée pour mettre fin à l’importation de médicaments de mauvaise qualité par les fabricants de médicaments en Europe, qui estampillaient les produits “suffisamment bons pour l’Amérique”. Cette loi a doté les inspecteurs des douanes américaines aux points d’entrée d’outils leur permettant d’identifier les médicaments non conformes aux normes ou falsifiés.
En réponse à la tragédie
Le rôle de la réglementation gouvernementale des médicaments a continué de croître au début du XXe siècle. Flacons d’antitoxine diphtérique. Malheureusement, cela s’est souvent produit en réponse à une tragédie résultant de l’utilisation de médicaments de mauvaise qualité. Dès la fin du 19e siècle, une injection d’antitoxine a sauvé la vie d’innombrables patients atteints de diphtérie, pour la plupart des enfants. Mais en 1901, le traitement est devenu mortel lorsque 13 enfants ont reçu une injection d’antitoxine diphtérique contaminée par le tétanos. Un médecin qui avait administré l’antitoxine diphtérique se lamente : “Là, j’ai découvert que la petite fille souffrait du tétanos (lockjaw). Je n’ai rien pu faire pour elle. Le poison avait été injecté si profondément dans son organisme qu’elle était hors de portée de toute aide médicale”. Les médecins et les patients faisaient confiance à l’antitoxine, mais sa pureté n’avait pas été vérifiée. Un cheval dont le sang avait été utilisé pour produire l’antitoxine diphtérique était mort du tétanos. La contamination aurait pu être découverte, mais le sérum n’avait pas été testé. L’antitoxine produite à partir du sérum contaminé a été distribuée et vendue, entraînant la mort des 13 enfants. Cette tragédie, ainsi qu’un incident similaire impliquant des vaccins antivarioliques, a conduit à l’adoption de nombreuses lois visant à contrôler et à réglementer la qualité des médicaments.
Et la chirurgie esthétique dans tout cela ?
La chirurgie esthétique englobe un large éventail de procédures pratiquées sur le corps humain pour en améliorer l’apparence et/ou la fonction. Elle peut être utilisée pour améliorer des caractéristiques physiques ou corriger des anomalies congénitales. La chirurgie esthétique est souvent pratiquée par des chirurgiens plasticiens, mais elle peut également être réalisée par des chirurgiens maxillo-faciaux ou des dermatologues.
Chirurgie des membres et de la silhouette
La chirurgie des membres comprend la reconstruction des mains, des doigts, des pieds et des orteils. Des chirurgiens esthétiques pratiquent également la liposuccion pour remodeler le corps. Le lifting corporel est une intervention chirurgicale qui consiste à retirer l’excès de peau de l’abdomen, des hanches ou des cuisses.
Chirurgie des membres et du corps
Les procédures de greffe de graisse sont utilisées pour améliorer les traits du visage avec des résultats naturels : des chirurgiens proposent des procédures reconstructives aux patients qui ont subi un traumatisme ou une maladie affectant leur apparence physique.
Chirurgie de l’obésité :
La chirurgie bariatrique désigne toute procédure de perte de poids pratiquée sur des personnes souffrant d’obésité morbide (obèses). Il peut s’agir d’un pontage gastrique ou d’un anneau gastrique.
Chirurgie faciale :
Les chirurgiens plasticiens du visage sont spécialisés dans le traitement d’affections telles que les rides et le vieillissement de la peau ; ils pratiquent également des interventions telles que le resurfaçage au laser qui améliore les cicatrices d’acné.
Chirurgie mammaire féminine :
Les patientes présentant un développement anormal des seins peuvent envisager une chirurgie de réduction mammaire afin de pouvoir vivre confortablement sans être gênées par leur image corporelle.
Chirurgie mammaire masculine :
Les hommes peuvent opter pour une réduction mammaire s’ils souffrent de gynécomastie (augmentation du volume des seins) due à des déséquilibres hormonaux ou à la consommation de drogues.
Chirurgie des membres et de la silhouette – Chirurgie reconstructrice
La chirurgie reconstructive est utilisée pour réparer les défauts causés par un traumatisme, une maladie ou une malformation congénitale. Elle peut être utilisée pour reconstruire les os, les muscles et les nerfs. La chirurgie reconstructive comprend également des procédures qui améliorent ou restaurent la fonction du visage et du corps.
Il peut s’agir de :
• une greffe osseuse pour la reconstruction du visage après un traitement contre le cancer
• la reconstruction de l’oreille à la suite d’une blessure (accident, par exemple) ou d’une ablation due à une infection
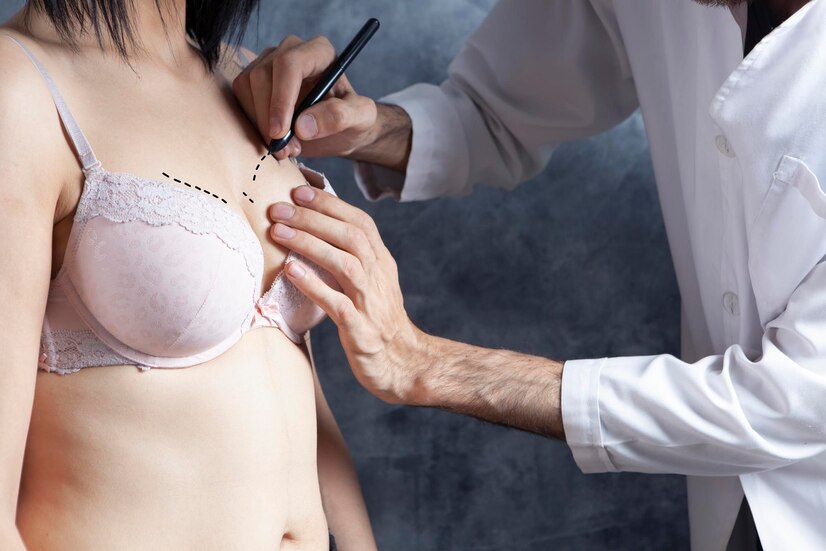
Et l’augmentation mammaire ?
L’augmentation mammaire, également connue sous le nom de mammoplastie d’augmentation, peut être une procédure cosmétique ou une procédure reconstructive dans le cas de la chirurgie de reconstruction mammaire. L’intervention consiste à insérer des implants sous les seins pour les augmenter.
Qu’est-ce que l’augmentation mammaire ?
Le type et la taille de l’implant dépendent de facteurs tels que l’ampleur que vous souhaitez donner à vos seins, votre anatomie mammaire, l’épaisseur et l’élasticité de votre peau et votre morphologie. Toute intervention chirurgicale ou invasive comporte des risques. Avant de procéder, vous devriez demander un second avis à un praticien de santé dûment qualifié.
Quelle est l’utilité d’un implant mammaire ?
Les implants mammaires peuvent être utilisés pour :
• Augmenter la taille des petits seins
• Restaurer le volume des seins après une perte de poids, une grossesse ou l’allaitement égaliser les seins asymétriques reconstruire un sein après une mastectomie ou une blessure.
Les deux principaux types d’implants mammaires utilisés sont les suivants :
- Les implants salins
- Une enveloppe de silicone remplie de quantités variables d’eau salée stérile (sérum physiologique). Cela peut affecter la forme, la fermeté et la sensation du sein. Si l’enveloppe de l’implant fuit, l’implant salin s’affaisse et la solution saline est absorbée et expulsée naturellement par le corps.
Implants en silicone
Une enveloppe de silicone remplie d’un gel élastique qui ressemble beaucoup au tissu mammaire naturel. Si l’implant fuit, le gel peut rester dans l’enveloppe de l’implant ou s’échapper dans la capsule cicatricielle (zone autour de l’implant) ou même dans le tissu mammaire. Un implant rempli de gel de silicone qui fuit peut ne pas s’affaisser.
Les implants sont placés derrière le sein, et non dans le tissu mammaire. Les implants peuvent être insérés soit :
• entre le tissu mammaire et le muscle pectoral
• derrière le grand muscle de la poitrine appelé grand pectoral.
Chaque position a ses avantages et ses inconvénients. Votre chirurgien plasticien spécialisé pourra vous fournir de plus amples informations et vous recommander la position qui vous conviendra le mieux.
Est-ce que cela me convient ?
L’augmentation mammaire est une intervention très personnalisée et peut ne pas convenir à tout le monde. Consultez toujours votre chirurgien plasticien spécialisé avant de prendre une décision. Votre chirurgien plasticien spécialisé évaluera votre état de santé général et planifiera le traitement qui vous convient le mieux.
Avant d’opter pour une augmentation mammaire par implants, il convient de garder à l’esprit certaines questions importantes :
Les implants mammaires peuvent affecter votre capacité à allaiter.
Les implants mammaires ne sont pas garantis à vie et une intervention chirurgicale ultérieure peut être nécessaire pour remplacer l’un des implants ou les deux. Les fumeurs courent un risque accru de complications, quelle que soit l’intervention chirurgicale. Si vous envisagez sérieusement de recourir à la chirurgie esthétique, vous devriez essayer d’arrêter de fumer
Si votre apparence vous préoccupe ou si vous envisagez des traitements cosmétiques pour renforcer votre confiance en vous, il existe des alternatives à la chirurgie esthétique. Il peut s’agir d’autres traitements, du port de soutiens-gorge rembourrés ou de l’acceptation de soi tel que l’on est.
L’augmentation mammaire peut être une bonne option pour vous si vous êtes en bonne santé physique
• Vous avez des attentes réalistes
• Vos seins sont complètement développés
• Vous avez l’impression que vos seins sont trop petits
• Vous n’êtes pas satisfaite de la perte de forme et de volume de vos seins à la suite d’une grossesse, d’une perte de poids ou du vieillissement.
Vos seins ont une taille ou une forme variable
L’un des seins ou les deux ne se sont pas développés normalement. N’oubliez pas que la forme et la taille de vos seins avant l’intervention influencent la procédure chirurgicale et le résultat.
Aurai-je besoin d’une anesthésie ?
L’augmentation mammaire à Genève par exemple peut être pratiquée sous différents types d’anesthésie, notamment l’anesthésie générale, l’anesthésie locale ou la sédation crépusculaire. Discutez de vos options avec votre chirurgien plasticien spécialisé.
L’anesthésie moderne est sûre et efficace, mais elle présente certains risques. Demandez plus d’informations à votre chirurgien plasticien spécialisé et à votre anesthésiste. Votre chirurgien et/ou votre anesthésiste vous interrogeront sur tous les médicaments que vous prenez ou avez pris, ainsi que sur vos éventuelles allergies. Assurez-vous d’avoir une liste à jour avant l’opération.